Réduction des oxydes métalliques
1. Introduction
Les métaux sont présents dans la nature sous forme oxydée (à l'exception de l'or). Un minerai contient généralement différents oxydes métalliques. La métallurgie extractive consiste à réduire les oxydes de manière à récupérer les métaux [1].
2. Thermodynamique de la formation des oxydes
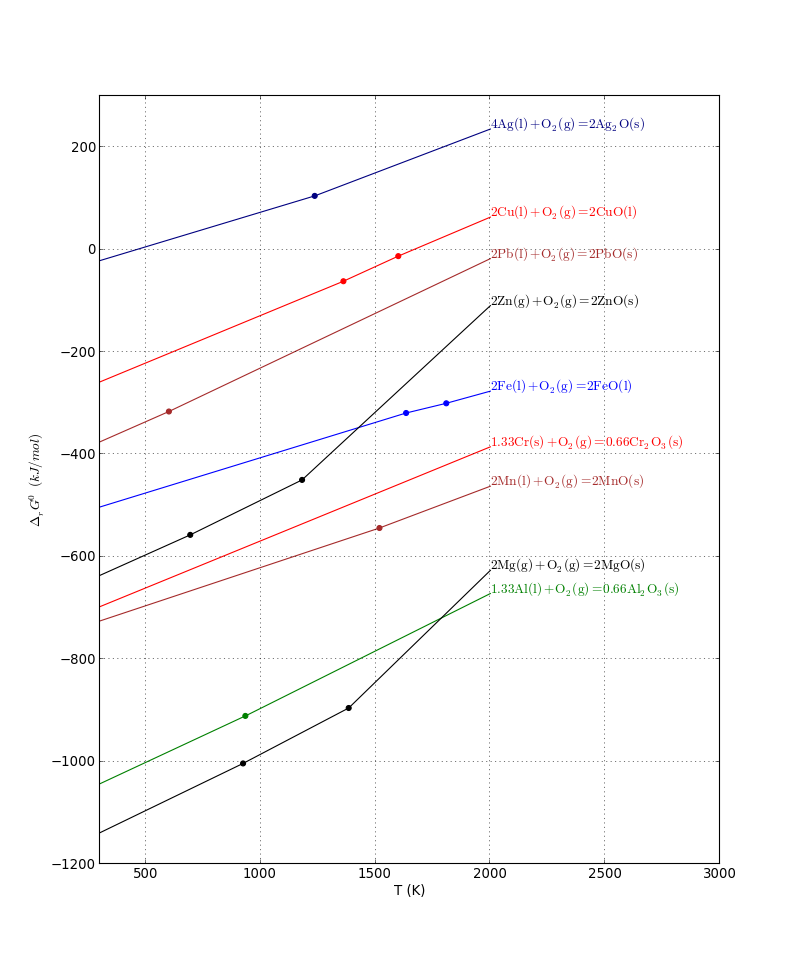
On s'intéresse à l'enthalpie libre standard de formation des oxydes métalliques. Les réactions sont écrites avec une mole de dioxygène. Le tracé des enthalpies libres standard de réaction en fonction de la température constitue le diagramme d'Ellingham.
On utilise le module de calcul Python décrit dans la page : Calcul des constantes d'équilibre.
from pylab import *
import sys
sys.path.append('../equilibre')
from thermochimie import *
th=Thermochimie("../equilibre/thermodata.txt")
G=EnthalpieLibre(th,"../equilibre/liste_reactions.txt")
figure(figsize=(10,12))
xlabel('T (K)')
ylabel(r'$\Delta_rG^0\ (kJ/mol)$')
G.plot(10,'r')
G.plot(11,'b')
G.plot(8,'g')
G.plot(9,'brown')
G.plot(4,'black')
G.plot(14,'black')
G.plot(15,'navy')
G.plot(16,'brown')
G.plot(17,'r')
axis([300,3000,-1200,300])
grid(True)
 plotA.pdf
plotA.pdf
La formation des oxydes est thermodynamiquement très favorable. Considérons par exemple la formation de l'oxyde de cuivre à 300 K :
L'enthalpie libre standard à cette température est (en kJ/mol):
print(G.gstandard(10,300)) --> -258.3686
L'enthalpie libre de la réaction (l'opposée de l'affinité chimique) s'écrit :
où .
On définit la pression d'équilibre en dioxygène par :
Dans le cas présent cette pression est (en bar) :
T=300
R=8.31
G0=G.gstandard(10,300)*1e3
print(exp(G0/(R*T))) --> 9.789289959016915e-46
L'enthalpie libre de la réaction s'écrit aussi :
La pression d'équilibre est si faible (pratiquement nulle) que la réaction évolue dans le sens de l'oxydation du cuivre quelque soit la pression partielle d'oxygène.
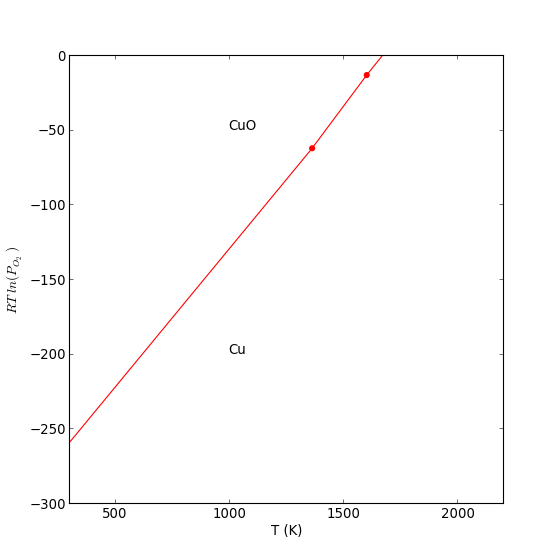
Dans le cas où l'oxyde et le métal sont solides ou liquides, le diagramme d'Ellingham peut s'interpréter en reportant en ordonnée (à la place de l'enthalpie libre standard) le rapport
Au dessus de la courbe, on a alors , ce qui définit le domaine de stabilité de l'oxyde. Inversement, le domaine de stabilité du métal est en dessous de la courbe :
figure(figsize=(7,7))
xlabel('T (K)')
ylabel(r'$RT\ ln(P_{O_2}\ )$')
G.plot(10,'r')
text(1000,-50,r'CuO')
text(1000,-200,r'Cu')
axis([300,2200,-300,0])
 plotB.pdf
plotB.pdf
3. Réduction des oxydes
3.a. Carbone et monoxyde de carbone
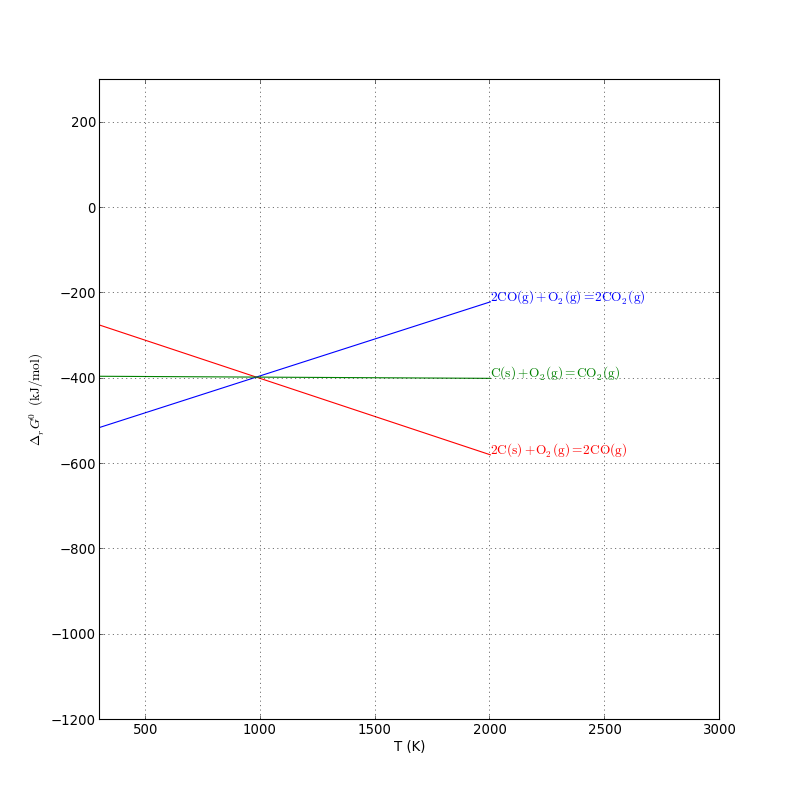
Le carbone et le monoxyde de carbone peuvent être utilisés comme réducteurs. Il faut étudier les réactions de formations suivantes :
figure(figsize=(10,10))
xlabel('T (K)')
ylabel(r'$\Delta_rG^0\ \rm(kJ/mol)$')
G.plot(1,'r')
G.plot(2,'b')
G.plot(3,'g')
#G.plot(7,'black')
#axis([300,3000,-600,0])
axis([300,3000,-1200,300])
grid(True)
 plotC.pdf
plotC.pdf
On considère la réaction de réduction du dioxyde de carbone par le carbone (réaction de Boudouard), qui permet de produire du monoxyde de carbone :
L'enthalpie libre standard de cette réaction est
Calculons l'enthalpie, l'entropie standard de cette réaction et sa température d'inversion :
[H,S]=th.reaction("C(s)+CO_2(g)=2*CO(g)")
print([H,S,H*1e3/S]) --> [172.45, 175.85999999999996, 980.6095757989312]
Cette réaction est favorable pour T>980 K. En pratique, il faut une température supérieure à 1300 K pour que la réaction de Boudouard ait une vitesse suffisante.
L'avantage du monoxyde de carbone (par rapport au carbone) est qu'il constitue un réducteur gazeux.
3.b. Réduction de l'oxyde de zinc par CO
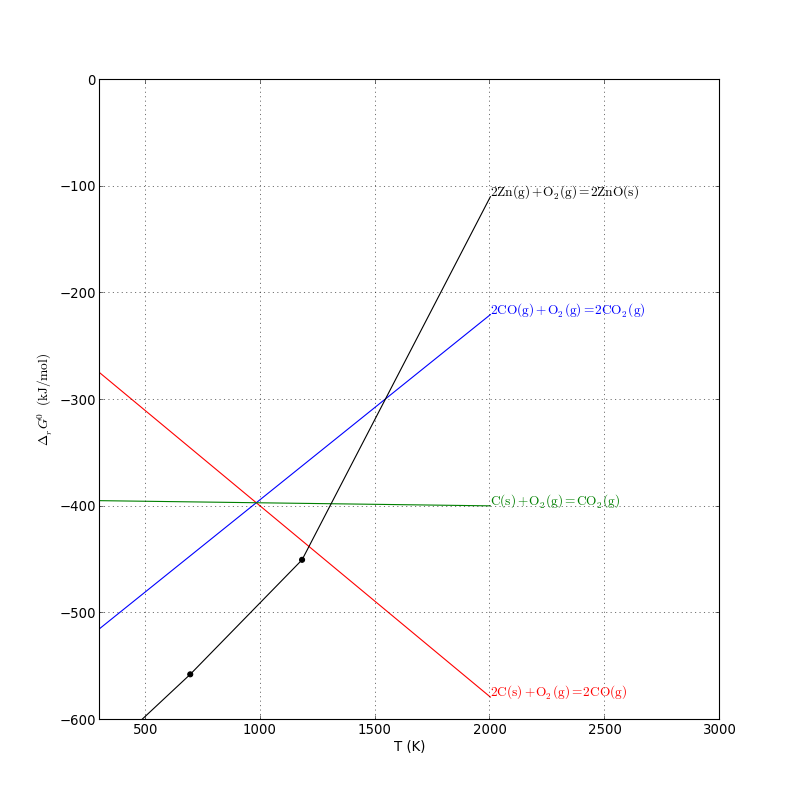
Cette réduction se fait dans un haut fourneau (procédé Imperial Smelting [1]). Elle est effectuée à une température où le zinc est gazeux (supérieure à 1180 K) :
Le monoxyde de carbone est obtenu avec la réaction de Boudouard, ce qui permet de regénérer le produit par la réduction de l'oxyde de zinc.
Le diagramme d'Ellingham permet de déterminer le domaine de température favorable à cette réduction :
figure(figsize=(10,10))
xlabel('T (K)')
ylabel(r'$\Delta_rG^0\ \rm (kJ/mol)$')
G.plot(1,'r')
G.plot(2,'b')
G.plot(3,'g')
G.plot(4,'black')
axis([300,3000,-600,0])
grid(True)
 plotD.pdf
plotD.pdf
La réduction par CO est favorable au dessus de 1550 K, température à laquelle la réaction de Boudouard est utilisable.
Remarque : on peut aussi effectuer une réduction par le carbone (carbothermie). En principe, celle-ci est favorable à une température nettement plus basse (environ 1200 K). Toutefois, la réaction entre phases solides étant très lente, c'est toujours le monoxyde de carbone qui intervient dans la réduction. Il faut donc opérer à une température assez haute pour favoriser la cinétique de la réaction de Boudouard.
3.c. Réduction des oxydes de fer
Dans un haut-fourneau, la réduction se fait par le monoxyde de carbone.
figure(figsize=(10,10))
xlabel('T (K)')
ylabel(r'$\Delta_rG^0\ \rm(kJ/mol)$')
G.plot(2,'b')
G.plot(11,'black')
G.plot(12,'black')
G.plot(13,'black')
axis([300,3000,-600,0])
grid(True)
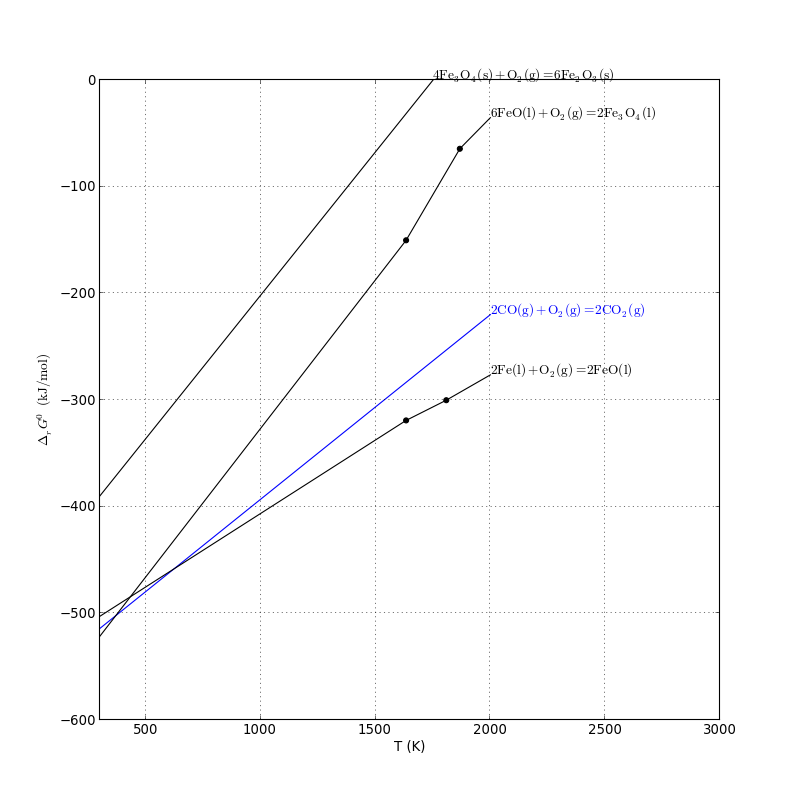 plotE.pdf
plotE.pdf
Pour obtenir du monoxyde de carbone par la réaction de Boudouard, on doit procéder au moins à T=1300 K. À cette température, la réduction de FeO n'est pas favorisée :
[DH,DS]=th.reaction("FeO(s)+CO(g)=Fe(s)+CO_2(g)")
T=1300
DG=DH*1e3-T*DS
print(DG) --> 11964.999999999916
La réduction se fait si l'enthalpie libre de la réaction est négative :
La constante d'équilibre est :
R=8.31 K=exp(-DG/(R*T))
print(K) --> 0.33036317014274008
On doit donc maintenir la pression de dioxyde de carbone assez basse pour avoir :