Corrosion humide
1. Phénomènes de corrosion
1.a. Réactions électrochimiques de corrosion
Dans la nature, les métaux sont principalement présents sous forme d'oxydes (Fe2O3, CuO2, Al2O3, etc.). Pour obtenir des métaux non oxydés, la métallurgie procède par réduction de ces oxydes. Les métaux au degré d'oxydation zéro sont, à quelques exceptions près, thermodynamiquement instables : ils sont oxydés par l'oxygène de l'air mais la réaction est heureusement extrêmement lente. En présence d'eau, ils peuvent subir une oxydation beaucoup plus rapide, de la part de l'eau elle-même ou bien de l'oxygène dissous dans l'eau. Ce phénomène est appelé corrosion humide. Il concerne les pièces métalliques partiellement ou complètement immergées, mais aussi les pièces soumises à l'humidité atmosphérique.
La corrosion humide est un phénomène électrochimique. Les deux réactions électrochimiques ayant lieu sur la surface du métal sont l'oxydation du métal, et la réduction de l'eau. Par exemple pour le fer, les deux réactions élémentaires sont :
La réaction de réduction de l'eau peut être écrite explicitement avec l'eau (écriture préférable en milieu neutre ou basique) :
Pour les calculs de potentiel, il faudra néanmoins utiliser la première forme, afin d'utiliser le potentiel standard du couple H+/H2 égal à 0 V.
Lorsque la concentration d'oxygène dissous dans l'eau est importante, il se produit aussi une réduction de l'oxygène :
La conséquence de ces deux réactions (oxydation anodique et réduction cathodique) est la dissolution du métal sous forme d'ion, du moins lorsque le pH est assez bas pour que l'ion ferreux soit stable. Au voisinage du métal, la formation d'ions hydroxyde rend l'eau basique, ce qui provoque la formation de . Celui-ci peut-être oxydé pour donner , qui peut se désydrater pour conduire à l'oxyde de fer . La rouille est un mélange d'hydroxydes et d'oxydes de fer. La photographie ci-dessous montre une canalisation ayant séjourné en milieu marin.
La présence de chlorure de sodium dans l'eau de mer accélère considérablement la corrosion, d'une part à cause de la conductivité importante de l'eau salée, d'autre part à cause d'un rôle spécifique de l'ion chlorure dans la cinétique de corrosion. La corrosion peut être uniforme, c'est-à-dire se dérouler sur toute la pièce uniformément. Le plus souvent, elle est localisée : elle se produit surtout sur certaines zones de la pièce, apparaissant d'abord sous forme de piqûres, puis de trous qui peuvent rapidement rendre la pièce inutilisable. La corrosion localisée est bien plus nocive que la corrosion uniforme.
Lorsqu'une plaque de fer est laissée 24 heures dans de l'eau salée à la concentration de l'eau de mer (30 g⋅L-1), voici le résultat (l'eau est agitée avant la prise de la photo, pour que la rouille se mette en suspension) :

La réaction bilan de la corrosion est une réaction d'oxydation du métal par l'eau. Cependant, cette réaction ne se fait pas directement. Il y a sur la surface du métal deux réactions électrochimiques distinctes. Le transfert d'électrons se fait par le métal et non directement entre l'atome métallique et l'espèce oxydante (eau ou dioxygène).
Figure pleine pageLe courant électrique d'une zone à l'autre de la pièce se fait par transfert d'électrons dans le métal, par transfert d'ions dans l'eau.
Pour mettre en évidence les réactions de corrosion, on place un clou en fer dans un gel (agar-agar) contenant de la phénolphtaléïne et du ferricyanure de potassium (). Voici ce qu'on observe après quelques jours :
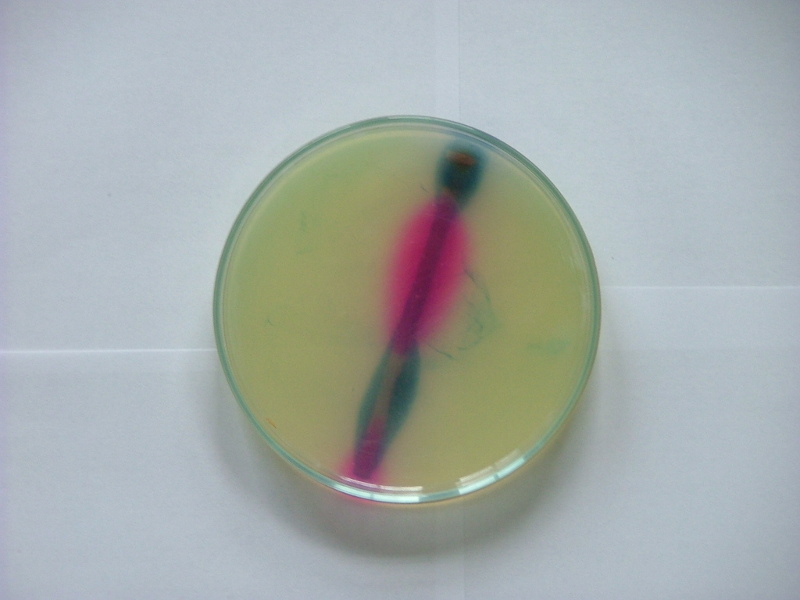
Le rose est dû au virage de la phénolphtaléïne dans les zones où apparaît. Le bleu est dû à la formation d'hexacyanoferrate de fer dans les zones où apparaît.
Cette expérience montre que l'oxydation du métal et la réduction, de l'eau ou de l'oxygène, peuvent avoir lieu sur des zones de la pièces différentes On parle dans ce cas de corrosion différentielle. Il se forme une pile de corrosion, constituée d'une zone d'oxydation anodique bien distincte à l'échelle macroscopique de la zone de réduction cathodique. Le courant électrique circule entre ces deux zones, par voie électronique dans le métal, par voie ionique dans le milieu aqueux. Certaines zones de la pièce, par exemple la tête du clou, sont sujêtes préférentiellement à l'oxydation du métal, en raison de différences de microstructure du métal ou bien de différences dans le milieu aqueux. La corrosion différentielle est favorisée dans un milieu aqueux très conducteur, par exemple l'eau de mer.
Figure pleine pageDans le cas d'une corrosion en apparence uniforme à l'échelle macroscopique, il peut aussi y avoir des micropiles de corrosion à l'échelle microscopique.
1.b. Étude thermodynamique
D'un point de vue thermodynamique, un métal est oxydé par l'eau si son potentiel d'équilibre (ou potentiel de Nernst) est inférieur à celui de l'eau :
Le potentiel de l'eau dépend du pH et celui du métal aussi en cas de formation d'hydroxyde métallique. On utilise donc un diagramme potentiel-pH pour savoir si un métal peut subir une corrosion.
Même en présence de corrosion, la concentration en ions métalliques au voisinage du métal est très faible. Cette concentration ne peut être connue avec précision, d'autant plus qu'elle dépend des mouvements de convection de l'eau au voisinage. On considère néanmoins que l'ordre de grandeur de la concentration pour une vitesse de corrosion moyenne est . Voici le diagramme potentiel-pH du fer établi pour cette concentration.
Figure pleine pageL'eau est un oxydant du fer quel que soit le pH. Cependant, la différence de potentiel augmente lorsque le pH diminue. Considérons en effet l'équation bilan :
Son enthalpie libre est reliée à la différence des potentiels des deux couples :
L'enthalpie libre de réaction est négative et sa valeur absolue est plus grande en milieu acide, où le pouvoir oxydant de l'eau est donc plus grand. Si l'on plonge un petit morceau de fer dans un acide fort concentré, on peut observer la formation de bulles d'hydrogène, et la destruction de la pièce se fait assez rapidement. Le dioxygène est un oxydant du fer très fort, mais sa concentration dans l'eau est heureusement très faible.
Voici le diagramme potentiel-pH du zinc :
Figure pleine pagePour le zinc, la différence de potentiel est plus grande que pour le fer. D'un point de vue thermodynamique, l'oxydation du zinc par l'eau et par le dioxygène est donc plus favorable que celle du fer.
Voyons le cas de l'aluminium :
Figure pleine pageL'aluminium est extrêmement oxydable. Les pièces en aluminium sont pourtant couramment utilisées (sans aucune protection) et semblent résister très longtemps à la corrosion. Ce paradoxe s'explique par la formation d'une couche d'oxyde Al2O3 sur la surface du métal. Cette couche mince très dense, d'une épaisseur de quelques nanomètres, empêche le métal sous jacent de subir une oxydation supplémentaire, ce qui a pour effet de stopper la corrosion. Ce phénomène est appelé passivation. Le film d'oxyde est appelé film passif.
Figure pleine pageLes métaux très oxydables (dont le potentiel est très bas) sont souvent passivables. Dans le cas de l'aluminium, le diagramme potentiel-pH montre qu'il y a un domaine de pH de passivité. En milieu très acide, l'aluminium est très fortement oxydé et se dissout dans l'eau.
En principe, la passivation peut se produire pour tout métal dans un domaine de pH où son oxydation conduit à une forme solide, pouvant éventuellement se fixer sur la surface du métal. En réalité, le film passif n'est pas toujours très solide. Sur les diagrammes potentiel-pH ci-dessus, la zone de passivité est grisée en clair. La zone d'immunité est grisé en foncé : lorsque le potentiel de la pièce métallique se trouve dans cette zone, elle ne subit pas de corrosion. Au contraire, si le potentiel se trouve dans une zone de corrosion (zone blanche), le métal subit une corrosion avec formation d'un ion soluble.
Les diagrammes potentiel-pH sont des diagrammes thermodynamiques, qui ne fournissent qu'une première information, très largement insuffisante pour expliquer les observations. Ils doivent être complétés par une étude cinétique, obtenue au moyen de courbes courant-potentiel.
1.c. Étude cinétique
Les processus de corrosion, même s'ils sont thermodynamiquement favorables, sont parfois très lents. Dans le cas du fer, la corrosion est tout de même assez rapide pour induire la formation de rouille en quelques jours, surtout en milieu marin. En milieu acide, la corrosion est encore plus rapide.
Pour faire une étude cinétique de la corrosion du fer, on utilise le montage à trois électrodes avec une électrode de travail en fer. La figure suivante montre la courbe obtenue dans une solution aqueuse d'acide sulfurique 0,5 mol⋅L-1, avec une plaque de fer préalablement nettoyée et poncée. La densité de courant est j=I/S où S est l'aire immergée de la plaque. En changeant S, on peut obtenir des courbes à différentes échelles de densité de courant.
Figure pleine pageCette courbe est appelée courbe de polarisation du métal. À la différence d'une courbe courant-potentiel d'un couple redox sur une électrode inerte, le couple en jeu dans l'oxydation (Fe2+/Fe) est différent du couple en jeu dans la réduction (H+/H2). En effet, la concentration en ion Fe2+ est trop faible pour contribuer de manière notable à la partie cathodique (j<0) et la concentration de H2 est trop faible pour contribuer à la partie anodique (j>0). Lorsqu'une courbe courant-potentiel fait intervenir deux couples différents, on parle de système mixte et de potentiel mixte.
Les courbes tracées en pointillé correspondent chacune à un couple. Elles ont été tracées au moyen d'un modèle car elles ne sont pas accessibles directement. Seule la courbe de polarisation peut être obtenue expérimentalement.
Pour ce pH (pratiquement nul), le potentiel du couple H+/H2 est très proche de 0 V. La réaction prépondérante dans la branche cathodique est la réduction de l'eau, mais on voit qu'elle est très lente. La réduction de H+ sur le fer est lente, alors qu'elle est rapide sur le platine. Dans la branche anodique, la réaction prépondérante est l'oxydation du fer, qui est aussi lente.
Pour un potentiel E le courant résulte de la somme du courant d'oxydation de Fe et du courant de réduction de H+ : . Lorsque j=0, le courant d'oxydation est opposé au courant de réduction : la valeur du potentiel correspondante est appelée potentiel de corrosion. Pour le fer dans l'acide sulfurique, le potentiel de corrosion est -0,23 V (dans cette expérience). Si la pièce de fer est plongée dans la solution sans être reliée à un circuit externe (électrode à l'abandon), elle a ce potentiel, que l'on mesure en la reliant à une électrode de référence via un voltmètre. Il se produit alors sur la pièce une oxydation du métal dont l'intensité du courant est exactement compensée par celle de la réduction de H+. La densité de courant au potentiel de corrosion est le courant de corrosion, noté jcorr. Cette densité permet de quantifier la vitesse de corrosion. Elle est en effet reliée à la vitesse de consommation du fer par :
Dans les conditions de l'expérience, la plaque constituant l'électrode de fer subit une corrosion uniforme (à l'échelle macroscopique). Il est donc possible de calculer une perte d'épaisseur par unité de temps à partir de cette vitesse de corrosion.
Malheureusement, le courant de corrosion n'est pas visible sur une courbe de polarisation. Il peut être obtenu indirectement en comparant les courbes à un modèle théorique. Dans une solution d'acide sulfurique, le courant de corrosion est de l'ordre de quelques mA par cm2. Cette valeur dépend beaucoup de l'état de surface de la pièce. Par exemple, une pièce en fer déjà rouillée est soumise à un courant de corrosion plus faible.
En milieu neutre, la corrosion du fer est beaucoup plus lente. En milieu marin, la présence d'ions chlorures est cependant un facteur accélérant la corrosion. La figure suivante montre la courbe de polarisation du fer obtenue dans une solution aqueuse de NaCl dont la concentration est voisine de celle de l'eau de mer.
Figure pleine pageLe potentiel de corrosion vaut -0,3 V. Il est donc plus bas qu'en milieu acide, ce qui indique une corrosion plus faible. Dans le cas d'un milieu neutre comportant de l'oxygène, la réaction de réduction prépondérante au voisinage du potentiel de corrosion est celle du dioxygène dissous dans l'eau. La réduction de l'eau intervient a des potentiels beaucoup plus bas. Pour E=Ecorr, situation qui correspond à une pièce de fer plongée dans la mer, le courant d'oxydation jox est le courant d'oxydation du fer; le courant de réduction jred est le courant de réduction de l'oxygène. Le courant de corrosion est beaucoup plus faible qu'en milieu acide car la concentration de O2 est faible et sa vitesse de réduction est très faible. La vitesse de réduction de O2 ne dépend pratiquement pas du potentiel, ce qui indique que l'intensité de réduction a atteint le courant limite de diffusion (le potentiel d'équilibre du couple O2/H2O est voisin de 0,8 V). La vitesse de corrosion est donc contrôlée par la diffusion du dioxygène au voisinage de la pièce en fer. En augmentant l'agitation on augmente le courant de réduction donc on augmente la vitesse de corrosion. Les coques de bateau en acier sont soumises à une corrosion intense car la convection est très forte.
Les deux figures ci-dessus montrent aussi la courbe de polarisation du zinc. En milieu acide, la différence de potentiel très élevée entre le couple H+/H2 et le couple Zn2+/Zn (visible sur le diagramme potentiel-pH) laisse prévoir une corrosion très intense. Cependant, la réduction de H+ sur le zinc est très lente et la corrosion du zinc reste modérée, bien que plus intense que celle du fer. On constate ainsi que le couple le plus lent limite la vitesse de corrosion. En milieu neutre oxygéné, la corrosion du zinc est un peu plus forte que celle du fer et l'espèce réduite est aussi le dioxygène.
1.d. Corrosion différentielle
La corrosion différentielle provient d'une hétérogénéité du métal ou du milieu. Certaines parties de la pièce métallique sont soumises à l'oxydation, alors que d'autres sont le siège de la réduction de l'eau ou de l'oxygène dissous.
Les hétérogénéités dans une pièce formée d'un seul métal proviennent de son usinage, ou des contraintes appliquées lors de l'assemblage des pièces. En particulier, les zones ayant subi de fortes contraintes mécaniques peuvent avoir une structure microscopique différente (phénomène d'écrouissage), qui modifie le potentiel d'oxydoréduction de la surface. Les zones d'écrouissage subissent plus facilement une corrosion que le reste de la pièce. Il se forme alors une pile, appelée pile de corrosion, dont l'anode est constituée par ces zones.
Figure pleine pageEntre les zones anodiques et cathodiques, il y a d'une part un courant électronique dans le métal, d'autre part un courant ionique dans le milieu. Ce phénomène est donc d'autant plus efficace que le milieu est conducteur. Dans l'eau de mer, la corrosion différentielle se fait très facilement. La corrosion est alors localisée, ce qui est bien plus nocif qu'une corrosion uniforme, car la tenue mécanique de la pièce peut être très vite réduite aux endroits de la corrosion.
Voici l'expérience présentée plus haut réalisée avec un clou tordu :
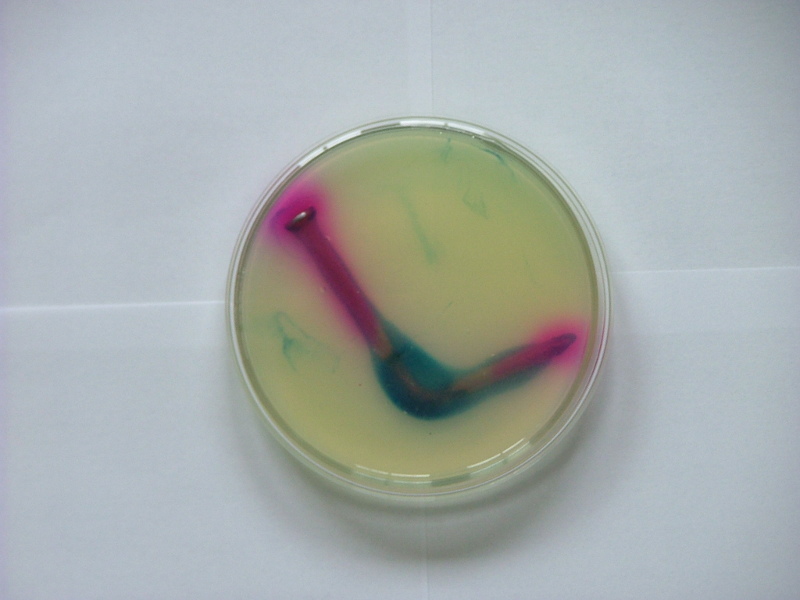
L'oxydation du fer se fait sur la zone ayant subi la déformation, la réduction de l'eau (ou du dioxygène) se fait sur le reste du clou.
Un exemple de corrosion différentielle par hétérogénéité du milieu est celui d'une différence de concentration en oxygène, pour une pièce partiellement immergée. La concentration en oxygène est plus forte au voisinage de la surface qu'en profondeur. Il se produit alors une pile de corrosion avec une réduction de l'oxygène près de la surface, et une oxydation du fer dans les zones les plus profondes.
Figure pleine pageLa photographie suivante montre un clou plongé dans un tube à essai. L'oxydation du fer se fait en profondeur, là où la concentration en dioxygène est plus faible.

1.e. Couplage galvanique de deux métaux
Une corrosion différentielle survient aussi lorsque deux métaux différents sont en contact. Le métal dont le potentiel est le plus bas subit une oxydation, l'autre métal est le siège d'une réduction de l'eau ou de l'oxygène. On parle dans ce cas de couplage galvanique entre les deux métaux.
Considérons l'exemple du contact Fer-Zinc. Le diagramme potentiel-pH montre que le potentiel du zinc est plus bas que celui du fer. Cette différence de potentiel apparaît entre deux électrodes en fer et en zinc plongées dans une solution salée.
Considérons une pièce en fer et une pièce en zinc (beaucoup plus petite) en contact électrique, plongées dans un milieu neutre aéré. On peut considérer qu'elles sont pratiquement au même potentiel. Pour trouver le point de fonctionnement du système, on trace la courbe courant-potentiel d'oxydation du zinc et celle de réduction de l'oxygène et de l'eau sur le fer. La pièce en zinc a une surface beaucoup plus petite. Il faut donc tracer l'intensité du courant et non pas la densité.
Figure pleine pageLe courant s'écoulant de la surface de la pièce en zinc vers l'eau est le courant anodique, d'intensité Ia; c'est aussi le courant qui provient de la pièce en fer. Le courant s'écoulant de la surface de la pièce en fer vers l'eau est le courant cathodique, d'intensité Ic. C'est aussi le courant qui provient de la pièce en zinc donc Ic=-Ia. Le point de fonctionnement s'obtient en supposant que les deux pièces sont au même potentiel, ce qui est vrai au moins pour les parties proches de la zone de contact. On en déduit le courant de corrosion du zinc Icorr=Ia=-Ic et le potentiel de corrosion. La position du point sur la courbe cathodique montre que O2 et H2O sont réduits sur le fer. La valeur très basse du potentiel de corrosion indique que l'oxydation du fer est négligeable.
2. Protection contre la corrosion
2.a. Passivation
Certains métaux et alliages, comme l'aluminium ou l'acier inoxydable, sont protégés par une mince couche d'oxyde qui se forme sur leur surface. Cette couche, de l'ordre de quelques nanomètres d'épaisseur, se forme dès que la pièce est refroidie, et la protège en empêchant l'eau ou l'oxygène de parvenir au contact du métal. La passivation explique pourquoi l'aluminium est un métal très peu oxydable alors que son potentiel est très bas. Bien que son oxydation soit thermodynamiquement très favorable, la passivation effectue un blocage cinétique.
Dans certains cas, il est possible d'effectuer une passivation de la surface d'un métal par une méthode électrochimique. Cette technique est utilisée pour protéger l'acier des cuves contenant de l'acide sulfurique concentré. La figure suivante montre la courbe de polarisation d'un fil de fer (surface très faible pour obtenir une forte densité) plongé dans une solution aqueuse d'acide sulfurique. La courbe est tracée en partant d'un potentiel très bas (-0,5 V) et en augmentant le potentiel très lentement, à la vitesse de 1 mV⋅s-1.
Figure pleine pageDans un premier temps, le courant d'oxydation augmente en raison d'une très forte oxydation du fer, avec un courant de plusieurs centaines de mA.cm-2. Au delà d'un certain potentiel, le courant décroît puis s'annule. Cela est dû à la formation d'un film passif sur la surface du fer (les ions sulfates entrent dans le composition de ce film). Pour maintenir ce film passif, il faut maintenir le potentiel dans le domaine de passivité avec un générateur. Ce film est mécaniquement très fragile. L'appareil doit donc être mesure de fournir un courant assez élevé pour reformer le film en cas de rupture locale. Cette méthode de protection du fer est complètement inefficace en milieu marin car ce film passif ne résiste pas à la présence des ions chlorures.
2.b. Protection par anode sacrificielle
Comme nous l'avons vu plus haut, si une pièce de zinc est fixée sur une pièce de fer, le zinc est oxydé et le fer est le siège d'une réduction de l'oxygène et de l'eau. L'anode de zinc est appelée anode sacrificielle.
Figure pleine pageCette méthode est utilisée sur les coques de bateau en fer (en complément de la protection par la peinture). Les deux photographies suivantes montrent des anodes neuves :


Les anodes doivent être changées avant leur épuisement complet. Voici deux anodes usagées :

2.c. Protection par peinture
La protection par peinture est la méthode la plus répandue. La peinture protège tant que son épaisseur est suffisante. En cas de mise à nu du métal à un endroit, une corrosion localisée survient rapidement.
Certaines peintures, en particulier pour les bateaux, contiennent de la poudre de zinc. En cas de trou dans la couche de peinture à la suite d'un choc ou d'une usure, le zinc a un effet protecteur sur les zones découvertes.
2.d. Protection par électrozinguage
L'électrozinguage est une technique d'électrolyse qui permet d'obtenir une couche de zinc sur des pièces en fer. Elle est utilisée par exemple pour protéger les clous et les vis en fer. Lorsque la couche est trouée à la suite d'un choc, l'effet protecteur par anode sacrificielle continu à agir.
2.e. Protection cathodique par courant imposé
La protection par courant imposé permet de protéger certaines pièces très sensibles ou d'accès difficile, comme des canalisations en contact avec un milieu corrosif. Elle consiste à faire circuler un courant cathodique en abaissant le potentiel de la pièce. Il se produit alors une réduction accélérée de l'eau et de l'oxygène sur la pièce, et pas ou très peu d'oxydation du métal. Cela revient à faire une électrolyse de l'eau en se servant de la pièce à protéger comme cathode.
Figure pleine pageLa courbe courant-potentiel permet de voir le courant à fournir pour protéger la pièce contre toute oxydation et le potentiel à appliquer. Celui-ci doit se trouver dans le domaine d'immunité du fer, c'est-à-dire là ou le courant d'oxydation du fer est négligeable.
Figure pleine pageSi l'anode est constituée d'un matériau inerte (par exemple le titane), l'oxydation anodique est celle de l'eau.
Cette méthode est aussi appelée protection cathodique par courant imposé. La protection par anode sacrificielle est d'ailleurs aussi une forme de protection cathodique.