Atome d'hydrogène
1. Fonction d'onde et nombres quantiques
L'atome d'hydrogène comporte un électron de charge -e et un noyau de charge +e. On définit l'atome hydrogénoïde comme un atome (ou ion) contenant un électron et un noyau de charge Ze.
Les différents états stationnaires de l'électron sont représentés par une fonction d'onde, fonction des coordonnées sphériques :
La probabilité de trouver l'électron a une position donnée dans un volume infinitésimal dv est :
L'électron est soumis au potentiel coulombien de la part du noyau. La résolution de l'équation de Schrödinger conduit aux fonctions d'ondes stationnaires suivantes :
R est la fonction radiale et Y la fonction angulaire. Les nombres quantiques entiers sont :
- n=1,2,3,... : nombre quantique principal
- l=0,...,n-1 : nombre quantique azimutal.
- m=-l,..,0,..,+l : nombre quantique magnétique.
On appelle orbitale la fonction d'onde définie par un triplet (n,l,m).
Le moment cinétique de l'électron est :
où h est la constante de Planck. La projection sur un axe z du moment cinétique est :
Pour un atome hydrogénoïde, l'énergie d'une orbitale ne dépend que du nombre quantique n :
où R est la constante de Rydberg définie par :
Les orbitales sont désignées par le nombre n suivi d'une lettre (s,p,d,f) indiquant le nombre quantique l. Par exemple les 3 orbitales 2p correspondent à n=2 et l=1.
Les fonctions suivantes (Mathematica) calculent la partie radiale de la fonction d'onde. L'unité de longueur est le rayon de Bohr (0,053 nm).
f[10,rho_]:=2; f[20,r_]:=1/(2*Sqrt[2])*(2-r); f[21,r_]:=1/(2*Sqrt[6])*r; f[30,r_]:=1/(9*Sqrt[3])*(6-4*r+4/9*r^2); f[31,r_]:=1/(9*Sqrt[6])*(4-2/3*r)*2/3*r; f[32,r_]:=1/(9*Sqrt[30])*4/9*r^2; f[40,r_]:=1/96*(24-18*r+3*r^2-1/8*r^3); f[41,r_]:=1/(64*Sqrt[15])*r*(20-5*r+1/4*r^2); f[42,r_]:=1/(384*Sqrt[5])*r^2*(6-1/2*r); f[43,r_]:=1/(768*Sqrt[35])*r^3; R[n_,l_,Z_,r_]:=f[n*10+l,Z*r]*Z^(3/2)*Exp[-Z*r/n];
2. Fonction de distribution radiale
La fonction de distribution radiale permet de calculer la probabilité de rencontrer l'électron à une distance r du noyau. Elle est définie par :
La probabilité de trouver l'électron entre les rayons r et r+dr est P(r)dr. La fonction suivante effectue le calcul :
P[n_,l_,Z_,r_]:=r^2*R[n,l,Z,r]^2;
<<PlotLegends`
La figure suivante représente le tracé de cette fonction pour les orbitales 1s, 2s et 2p de l'atome d'hydrogène (Z=1) :
Plot[{P[1,0,1,r],P[2,0,1,r],P[2,1,1,r]},{r,0,10},PlotRange->{Full,Full},AxesLabel->{'r','P'},
PlotLegend->{Style['1s',16],Style['2s',16],Style['2p',16]},LegendPosition->{1.1,-0.4},LegendSize->{0.3,0.3},LegendShadow->None,
PlotStyle->Thick,BaseStyle->{FontSize->16},PlotLabel->Style['Fonction de distribution radiale',16]]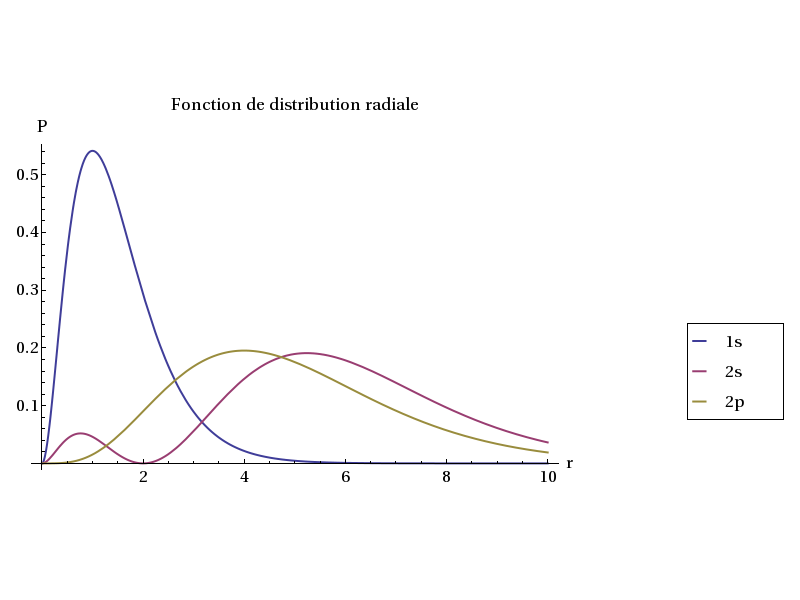 figA.pdf
figA.pdf
Ci-dessous les orbitales 3s, 3p, et 3d (remarquer la différence d'échelle) :
Plot[{P[3,0,1,r],P[3,1,1,r],P[3,2,1,r]},{r,0,20},PlotRange->{Full,Full},AxesLabel->{'r','P'},
PlotLegend->{Style['3s',16],Style['3p',16],Style['3d',16]},LegendPosition->{1.1,-0.4},LegendSize->{0.3,0.3},LegendShadow->None,
PlotStyle->Thick,BaseStyle->{FontSize->16},PlotLabel->Style['Fonction de distribution radiale',16]]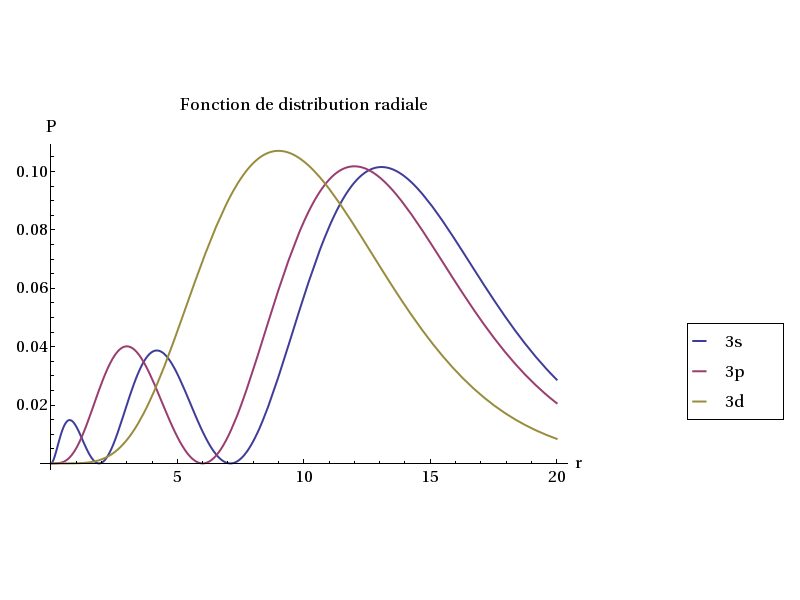 figB.pdf
figB.pdf
Orbitales 4s, 4p, 4d et 4f :
Plot[{P[4,0,1,r],P[4,1,1,r],P[4,2,1,r],P[4,3,1,r]},{r,0,40},PlotRange->{Full,Full},AxesLabel->{'r','P'},
PlotLegend->{Style['4s',16],Style['4p',16],Style['4d',16],Style['4f',16]},LegendPosition->{1.1,-0.4},LegendSize->{0.3,0.3},LegendShadow->None,
PlotStyle->Thick,BaseStyle->{FontSize->16},PlotLabel->Style['Fonction de distribution radiale',16]]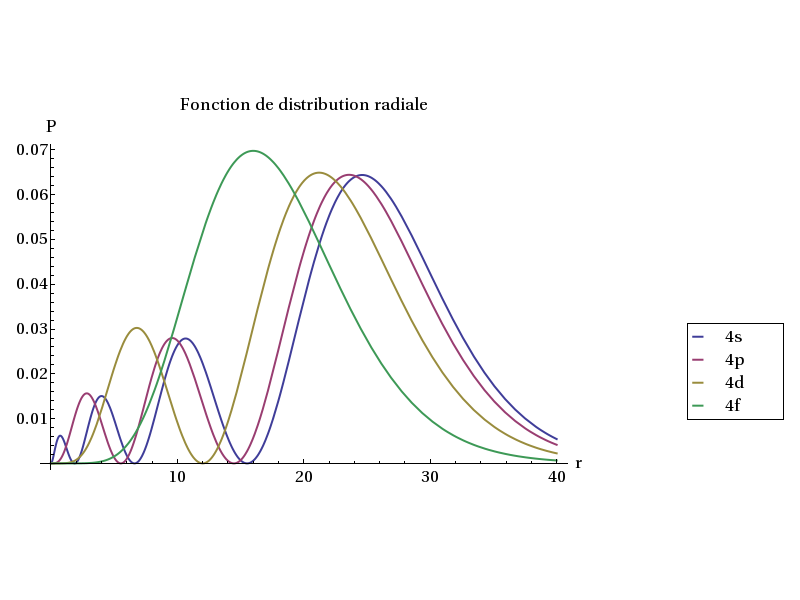 figB1.pdf
figB1.pdf
3. Partie angulaire de la fonction d'onde
La partie angulaire de la fonction d'onde est une harmonique sphérique :
Y[n_,l_,theta_,phi_]:=SphericalHarmonicY[n,l,theta,phi];
Pour la représenter graphiquement, on reporte pour chaque position angulaire (θ,ϕ) une longueur égale au carré du module de Yn,l.
Voici la représentation de la partie angulaire de l'orbitale 1s :
SphericalPlot3D[Abs[Y[0,0,theta,phi]]^2,{theta,0,Pi},{phi,0,2*Pi},PlotLabel->'1s']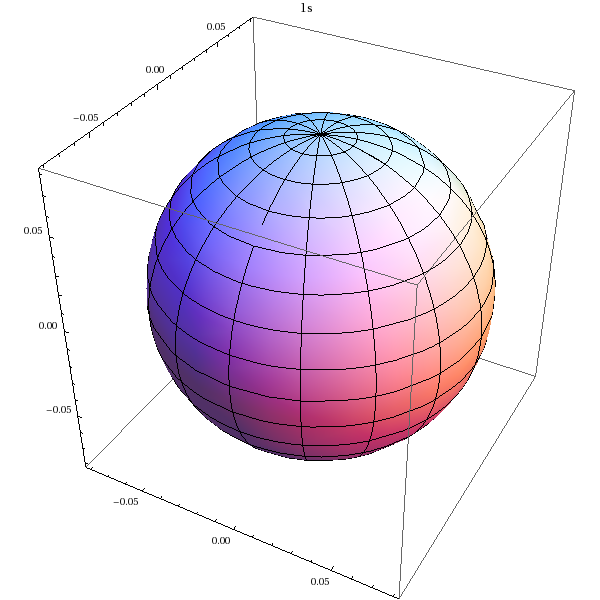
Orbitale 2p (m=0):
SphericalPlot3D[Abs[Y[1,0,theta,phi]]^2,{theta,0,Pi},{phi,0,2*Pi},PlotLabel->'2p']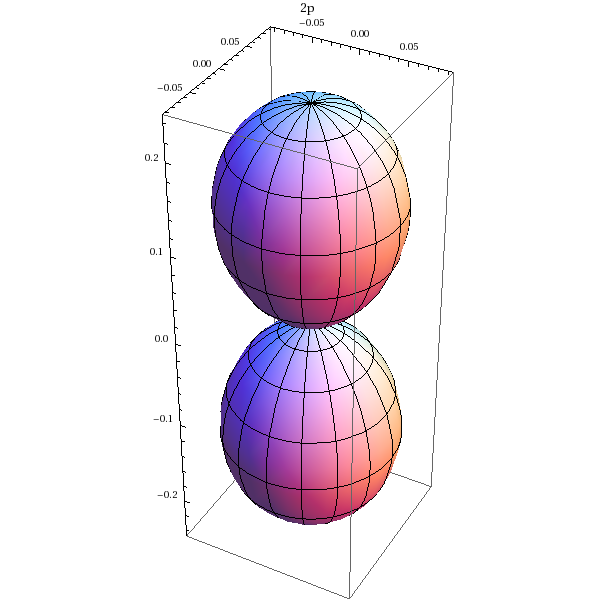
Orbitale 3d (m=0):
SphericalPlot3D[Abs[Y[2,0,theta,phi]]^2,{theta,0,Pi},{phi,0,2*Pi},PlotLabel->'3d']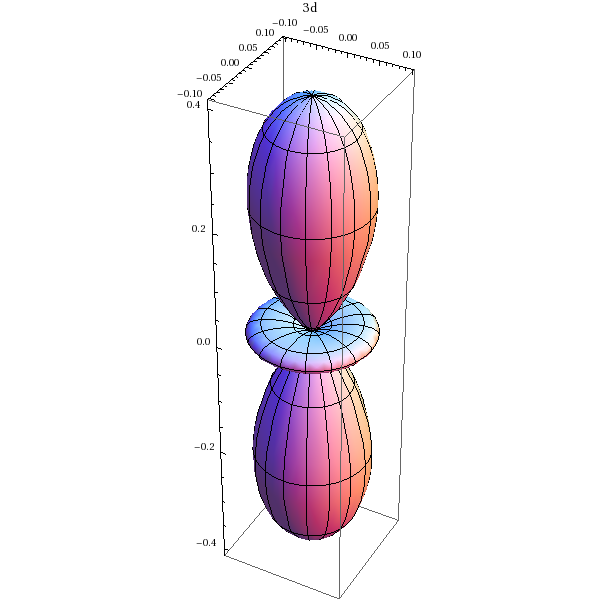
Orbitale 3d (m=1):
SphericalPlot3D[Abs[Y[2,1,theta,phi]]^2,{theta,0,Pi},{phi,0,2*Pi},PlotLabel->'3d']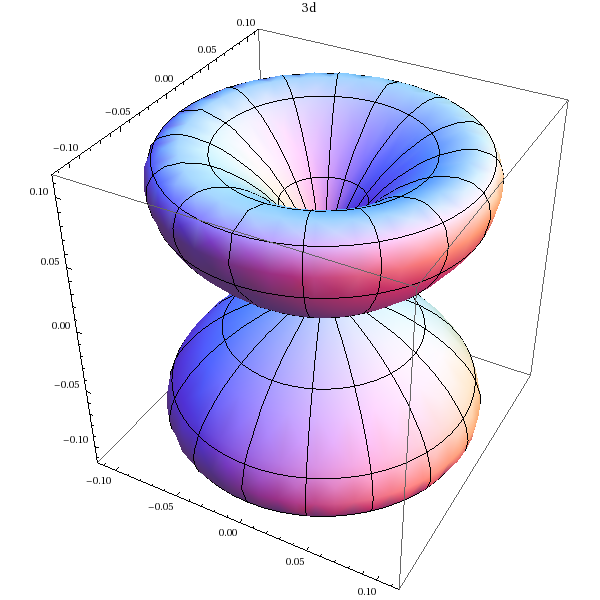
Orbitale 3d (m=2):
SphericalPlot3D[Abs[Y[2,2,theta,phi]]^2,{theta,0,Pi},{phi,0,2*Pi},PlotLabel->'3d']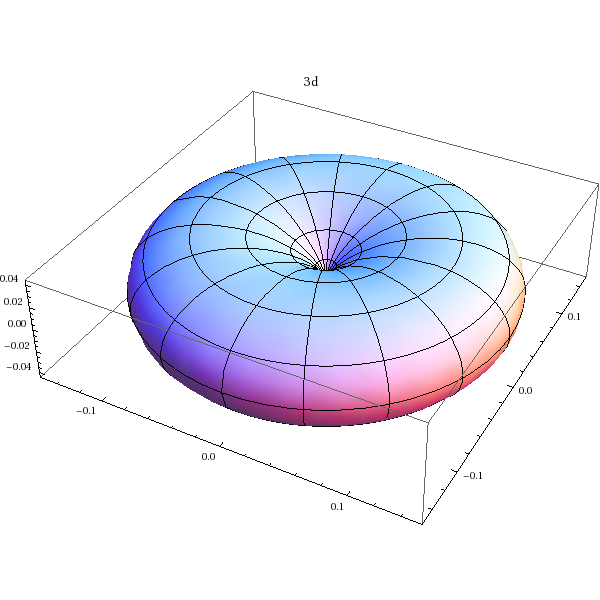
4. Niveaux d'énergie
L'énergie des orbitales de l'atome d'hydrogène (Z=1) est donnée par :
où EI est l'énergie d'ionisation de l'atome d'hydrogène lorsqu'il est dans son état fondamental (orbitale 1s). Sa valeur est :
Le diagramme suivant représente les niveaux d'énergie de l'atome d'hydrogène, ainsi que quelques transitions avec la longueur d'onde du photon émis.
Figure pleine page